预防癌症的第一道防线
几种抗癌药物联合使用有望预防癌症。
美国休斯顿MD安德森癌症中心(MD Anderson Cancer Center)Xiangwei Wu实验室里饲养的小白鼠好像能够幸免于难。这些小白鼠都是经过遗传改造,注定会患上结肠癌的小鼠,不过在最新的“肿瘤清除疗法(cancer cleansing)”的帮助下,它们得以存活下来。Wu每三个礼拜都会给这些结肠癌小鼠注射一次药物混合制剂,这些药物全都是特异性靶定突变细胞的药物,所以没有什么副作用,也没有给小鼠带来任何可见的损伤。这些小鼠“享受”的是目前为止最为超前的疗法,该疗法的理念是通过短期用药以达到长期防癌的目的。
使用药物来预防,而不是治疗癌症其实并不是什么新点子。实际上,在近几十年时间里,学界早就兴起了一股“药物防癌法(chemoprevention)”。只需服食一片药就能预防肿瘤的发生,这的确是一个非常诱人的想法。不过,现实永远都不会那么尽如人意。各种遗传突变都有可能促使细胞癌变,我们既很难预测出细胞会发生哪些突变,也很难预料出哪些细胞会发生突变。如果想要“抓住”突变发生的一瞬间进行研究则更是难上加难,至少在人体试验中还做不到这一点。科研人员现在还无法对一个尚未产生的疾病开展研究,这也就是说预防疾病发生其实就是一场生物分子学打地鼠游戏。药物的副作用更是让情况变得愈加复杂。长期用药可能会给人体带来非常严重的副作用,甚至会让患者患上其它疾病。
肿瘤的形成、发展可以是一个进展非常缓慢的过程。早在35年前就提出了“药物防癌法”概念的美国达特茅斯药理学家Michael Sporn举例——有一位妇女患了乳腺癌20年之后才发现自己的乳房有肿块。这么长的时间足够我们进行早期干预。很多细胞发生突变之后只能说它们不太健康,但还远远达不到癌变细胞的标准。这些癌前细胞(precancerous cell)只有通过转化之后才会真正变成永生化的、生长不受控制的癌细胞。很多肿瘤发生转移时转移的细胞实际上就是这些癌前细胞,它们负责在体内各处形成转移灶。
所以,能够用药物在肿瘤形成的早期进行干预是最佳的防癌方案。不过,绝大多数的科研人员都觉得只要药物能够阻止肿瘤进一步发展就足够了。
抑制炎症反应
打断肿瘤形成链条中的第一环是最佳选择,意即在所有没有被人体免疫系统杀灭的“漏网”突变细胞真正癌变之前就将它们彻底清除掉。不过这一点很难办到。因为我们很难发现人体中出现的早期突变,而且那些早期防癌药物必须是对人体完全无害的,只有这样才能做到长期甚至是终身用药。
很多人最开始都认为最好的办法是调动人体自身的免疫机制来清除突变细胞。但是,慢性炎症反应本身就是一种促癌机制,它会促进新生血管生成,促进细胞外机制重构,所有这一切都为正常细胞癌变创造了极佳的环境。
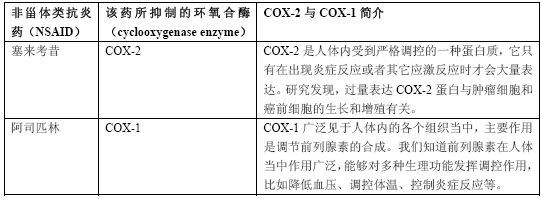
炎症反应是人体抵御从心脏病到糖尿病等各种疾病的根本机制。调动免疫机制不仅能够防癌,还能够预防其它疾病。基于这种理念,科研人员们逐渐将目光锁定到了两款药物上面,它们是塞来考昔(celecoxib)和阿司匹林(aspirin)(表1)。
表1 塞来考昔和阿司匹林及它们靶向的环氧合酶
注:1. 环氧合酶在炎症反应和疼痛反应中具有关键作用。2. 塞来考昔与阿司匹林能够降低罹患结肠癌和其它癌症的风险。3. 抑制COX信号通路能够通过减少新生血管生成、抑制细胞生长的途径扭转细胞癌变的进程。而且,抑制COX信号通路还能够促进已发生突变的细胞凋亡;促使人体免疫系统识别并清除体内的变异细胞。
塞来考昔和罗非考昔(rofecoxib,商品名万络Vioxx,该商品已经因不良反应退市)等其它COX-2蛋白抑制剂已经成为了阿司匹林的替代品,因为长期使用阿司匹林有可能会导致消化道出血。有一段时期,我们一度都没有将这些药物看作解热镇痛药,而是将它们看作防癌药物。美国食品与药品监督管理局(FDA)建议家族性腺瘤性息肉病(familial adenomatous polyposis,FAP,这是一种比较少见的遗传性疾病,主要病理变化是大肠内广泛出现数十到数百个大小不一的息肉)患者应该每天服用一定剂量的塞来考昔,以降低罹患结肠癌的风险。早期报道称,每日服用COX-2蛋白抑制剂能够降低乳腺癌、皮肤癌以及结肠癌等癌症高危人群罹患这些肿瘤的风险。目前来看,COX-2蛋白抑制剂类药物还是一款前景非常光明的防癌药物,因为市面上还没有第二种作用于同一信号通路的药物出现。
不过其后发现,长期服用COX-2蛋白抑制剂会增加患者中风和心梗的发病几率,美国FDA也因此禁止绝大部分的COX-2蛋白抑制剂在市面上销售。直到2011年2月初,市面上都还能够看到塞来考昔,不过之后,制药厂商主动修改了塞来考昔的适应症,因为它没能够完成重复实验。即便如此,还是有一些癌症预防研究人员没有放弃塞来考昔,他们继续开展研究,希望能够对塞来考昔进行改良,研制出复合物制剂,既能够保持塞来考昔的防癌功效,同时又能够避免发生心血管方面的副作用。
美国华盛顿国家癌症研究所(National Cancer Institute, NCI)肿瘤预防部门(cancer prevention division)负责临床研究工作的副主任Leslie Ford介绍,阿司匹林有它自身的问题,很多人因为服用阿司匹林后出现的副作用死亡。美国每年大约有1.6万人因为使用阿司匹林导致消化道大出血而死亡。然而这并没有阻止临床试验的脚步,越来越多的研究证明,阿司匹林的确能够降低结肠癌、肺癌、前列腺癌甚至颅内肿瘤的发病风险。
其它针对人体全身炎症反应的药物也能够对各种癌症发挥一定的预防作用。有研究表明,主要用于调节血脂的他汀类药物(statins)可能也能够抑制肿瘤细胞的生长和增殖。报告显示,我们用于治疗II型糖尿病人,提高他们身体对胰岛素敏感性的药物能够有效地降低颅内肿瘤、肺癌以及头颈部肿瘤等多种癌症的发病风险。这一类药物包括二甲双胍(metformin)、匹格列酮(pioglitazone)以及罗西格列酮(rosiglitazone)等。不过,最近有报道称罗西格列酮可能也会导致一些心脏问题。
我们目前还不知道上述这些药物是通过哪些机制来发挥防癌功效。美国MD安德森癌症中心负责癌症预防和流行病学研究工作的Ernest Hawk指出,每当他发现有一款药物在试验时表现出对某一条信号通路具有非常明显的作用时,都会同时发现它还具有很多其它的活性。所以最后他不得不产生疑问,人们真的了解药物的作用机制吗?
“抓住”癌前细胞
现在,大部分防癌药物的作用机制都是尽可能避免癌前细胞真的转化成癌细胞。这些药物都有其明确的细胞作用靶点,主要应用人群都是那些有家族病史或者检出遗传突变,甚至是发现了体内存在癌前细胞的高危人群。
美国国家癌症研究所从事癌症预防工作的研究员Eva Szabo介绍,因为各种肿瘤的发生发展途径都各不相同,所以他们也不可能找出一种放之四海而皆准的防癌准则。目前在防癌领域里面临的最大挑战就是他们并不止面对一个防癌领域。在他们真正认识到癌症的复杂性以前,他们一直都以为能够找到一种通用方案,能够解决所有的转化细胞。据Szabo介绍,现在已经非常明确地知道,肺癌、乳腺癌和结肠癌都具有多种形式。由于它们的致病机制不同,所以预防措施也会有所差异。
在美国FDA批准能够用于治疗癌前细胞疾病或者降低患癌风险的药物中,绝大部分都属于预防性质的药物。比如,妇女用来降低乳腺癌患病风险的雷洛昔芬(raloxifene,商品名Evista)或他莫昔芬(tamoxifen,商品名Nolvadex)都能够让雌激素受体(estrogenreceptor)阳性的妇女罹患乳腺癌的风险降低50%。现在,又有五款霜剂和膏剂被批准用于防止皮损演变为鳞状细胞癌等皮肤癌。
Xiangwei Wu实验室饲养的易患结肠癌的小鼠也属于这个范畴。Wu使用的由两种药物构成的合剂就能够专门针对结肠癌前细胞特有的突变位点发挥作用,促进并且只促进这些突变细胞死亡。Wu介绍,因为大部分预防性药物并不能清除突变细胞,所以他们只能长期使用这些药物。比如雷洛昔芬(raloxifene)和他莫昔芬(tamoxifen)就都属于这种情况。
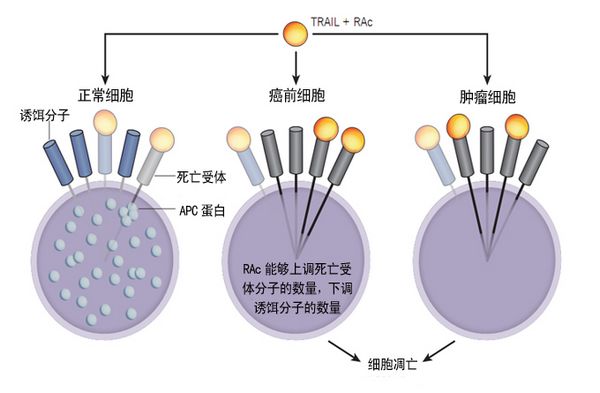
不过,Wu的小鼠非常幸运,似乎所有的好事全给它们碰上了。比如,它们接受的是间断性疗法,但是也足以杀灭所有的突变细胞,而且这种间断疗法因为存在停药期,所以能够避免出现副作用。另外,Wu使用的两种药物——肿瘤坏死因子相关促凋亡药物(tumour necrosis factor-related apoptosis-inducing ligand, TRAIL)和全反式视黄醇乙酸酯(all-trans-retinyl acetate, RAc)还能够发挥协同效应。很多科研人员都认为这种方法可以用于治疗因为耐药而复发的癌症患者。已经有证据表明,TRAIL在癌症防治方面前途光明,因为它并不会对正常细胞造成损伤,只会促进癌细胞凋亡。Wu发现,如果将TRAIL与Rac联用,TRAIL还能够促进癌前细胞凋亡。
二联防癌复合制剂作用机制示意图。TRAIL与受体结合之后能够促使细胞凋亡。正常细胞会受到诱饵受体分子和APC蛋白的保护,可以避免细胞凋亡。RAc能够通过下调诱饵受体分子数量的方式促进癌前细胞凋亡。
还有一项两种药物联用的方法也能够对预防结肠癌的发生起到非常好的疗效,这就是将低剂量的NSAID类药物舒林酸(sulindac)与二氟甲基鸟氨酸(difluoromethylornithine ,DFMO)合用。据美国加州大学(University of California)的研究人员Irvine介绍,这两种药物联用的效果要远远好于单独使用任何一种药物的效果。该校欧文分校医学院附属Chao综合性肿瘤中心(Chao Family Comprehensive Cancer Center)的主任Frank Meyskens表示,他们还将进一步开展研究,找到最低的有效剂量。
这种联合用药实际上起到了一种既推且拉的作用。肿瘤细胞难以正常调控多胺类物质的代谢活动,因此在肿瘤细胞里这类物质的含量异常升高,而在正常细胞中,多胺类物质是能够帮助细胞生长和发育的有用成分。DFMO能够阻止多胺类物质的合成,舒林酸又能够促进细胞清除多胺类物质。所以,只需要很少量的DFMO和舒林酸就能够起到降低癌前细胞中多胺类物质含量的作用,从而抑制癌前细胞生长,降低结肠癌的发病风险。Meyskens等人在临床试验中发现,经过为期三年的治疗,联合用药组人群结肠息肉的发病率减少了70%,对极易癌变的进展期腺瘤的抑制率更是超过了90%。有研究者发现,Cancer Prevention制药公司已经在开展这种结合用药疗法的III期临床试验。
防止肿瘤转移
对于绝大多数实体瘤来说,最危险的莫过于肿瘤发生转移。所谓肿瘤转移,指的是在原发灶继续增长的同时,有部分恶变细胞从原发灶处脱落,通过血液流动转移到身体别处,并且在别处继续生长,形成新的肿瘤灶,即转移灶。肿瘤具备转移能力意味着肿瘤细胞积累了大量的遗传突变,这些突变是传统抗癌药物无法一次全部“搞定”的。
美国芝加哥西北大学医学院(Northwestern University medical school)的防癌专家Raymond Bergan指出,所有肿瘤都会随着时间的流逝,积累大量的遗传突变,而且这种突变的积累速度是指数级别的。人们开发针对其中一个突变靶点的药物比较容易,但是想要让一种药物针对两个不同的靶点就非常困难。
Bergan的研究方向是阻止肿瘤原发灶的生长和转移。他的实验室一直在研究一种大豆异黄酮成分——染料木黄酮(genistein)。这种物质一直都被当做营养补充剂使用。Bergan小组一直在测试这种物质的活性,结果发现它不仅能够很好地预防前列腺癌的转移,甚至能够逆转前列腺癌的转移过程。
肿瘤细胞如果要发生转移,首先就要与周围组织分离。这种降低粘附力的作用至少有部分是依靠黏着斑激酶(focal adhesion kinase)的作用来实现的。研究发现,染料木黄酮能够阻止黏着斑激酶激活,因此前列腺肿瘤细胞就无法脱离,只能继续牢牢的“固定”在原处。
染料木黄酮还能够阻止已经脱离的游离前列腺肿瘤细胞侵入其它健康组织。在正常细胞的生长和分裂过程中,基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)会帮助细胞溶解胞外的膜蛋白,打开一片生长的空间。不过,在被MMP-2降解的蛋白中有一种蛋白也是肿瘤细胞侵入时首先攻击的靶标。研究人员发现,肿瘤患者体内MMP-2蛋白的浓度越高,患者的预后越差。染料木黄酮能够逆转这个过程,因为它能够特异性地针对一种蛋白发挥作用,而这个靶蛋白的功能就是增加体内MMP-2蛋白的浓度。所以染料木黄酮通过与该靶蛋白结合并抑制其活性的方式抑制了体内MMP-2蛋白的合成途径。
Bergan他们在II期临床试验中发现染料木黄酮能够降低人体前列腺组织中MMP-2蛋白的含量,他们现在正在研究是否因为这个原因导致前列腺癌细胞无法扩散、转移。同在美国西北大学的Seema Khan也在开展同样的工作。他们正在研究染料木黄酮是否也能阻止乳腺癌的转移。据Khan介绍,她的研究成果表明,年轻妇女如果使用染料木黄酮反而有可能会导致细胞增殖能力轻度增高,不过这还不是最终的研究结论。
实际上,在肿瘤预防研究工作中,不确定性和模棱两可是非常常见的情况。美国西雅图Fred Hutchinson肿瘤研究中心(Fred Hutchinson Cancer Research Center)的资深顾问John Potter这样评价:我认为我们有足够多的例子能够说明药物防癌方法是有害的,这也正说明我们对这方面的了解非常浅薄,如果让我为药物防癌方法起草一份指导意见,那么我首先要做的就是权衡一下利弊得失。
针对每一种疗法都先评估一下风险,这个办法应该会有帮助。MD安德森癌症中心临床癌症预防部分的主任Powel Brown指出,大多数人都认为预防癌症就和预防脊髓灰质炎一样简单——只要吃一粒药丸就可以一辈子高枕无忧了。但实际上,预防癌症就好像通过控制血脂来防止患上心肌梗死一样困难。也就是说,患者用药是在非常不确定的情况下进行的,而且因为药物存在副作用,所以需要权衡利弊之后才能决定用药预防是否真的值得。
实际上,如果科研人员和临床医生们能够建立起一套好像预防心脏疾病那样的防癌系统,那么我们就有可能取得最终的成功。目前,该领域的研究人员还只能对Wu实验室的小鼠进行研究,不过这些小鼠也为我们指明了一条方向,如果将来我们依然无法免受癌症的困扰,那么我们至少能够控制癌症。
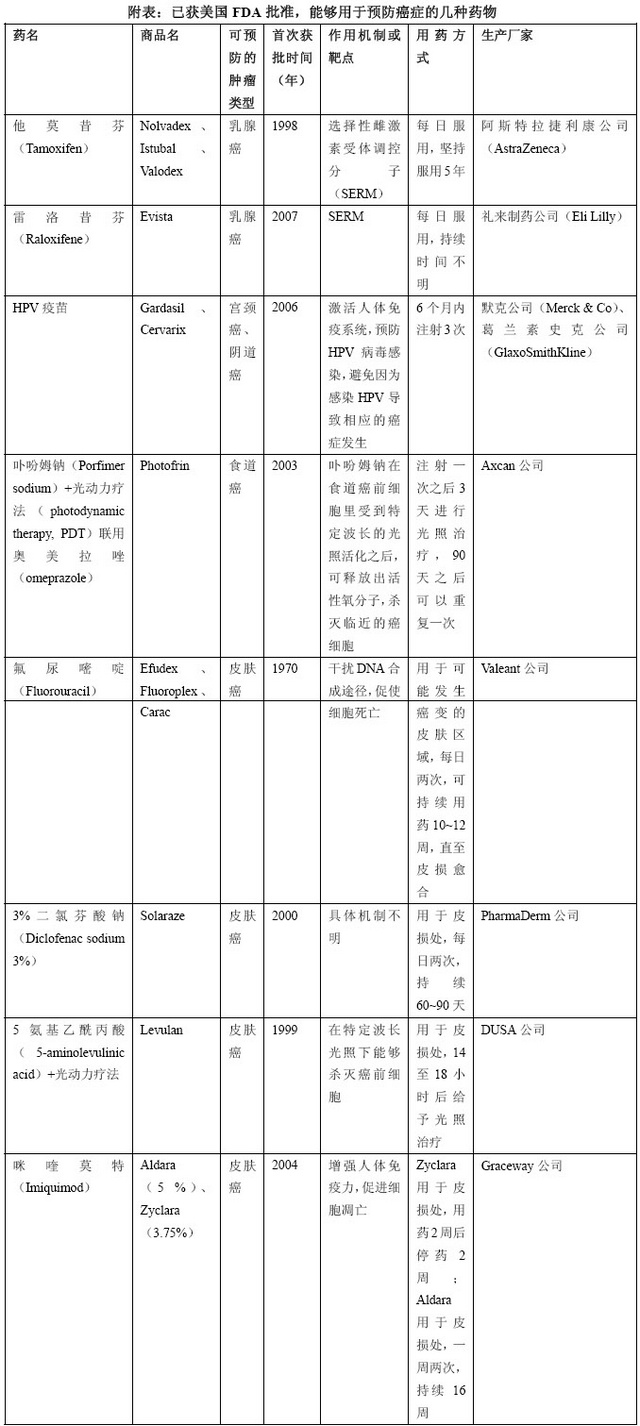
附表:已获美国FDA批准,能够用于预防癌症的几种药物
原文检索:
Lauren Gravitz. (2011) First line of defence. Nature, 471:s5-s7.
筱玥/编译